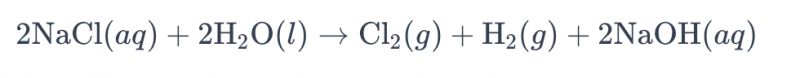Processen att elektrolysera en saltlösning med titanelektroder för att producera klor kallas vanligtvis "elektrolys av saltlösning". I denna process används titanelektroder för att underlätta oxidationsreaktionen av kloridjoner i saltlösningen, vilket leder till generering av klorgas. Den övergripande kemiska ekvationen för reaktionen är följande:
I denna ekvation oxideras kloridjoner vid anoden, vilket resulterar i produktionen av klorgas, medan vattenmolekyler reduceras vid katoden, vilket ger vätgas. Dessutom reduceras hydroxidjoner vid anoden, vilket bildar vätgas och natriumhydroxid.
Valet av titanelektroder beror på titans utmärkta korrosionsbeständighet och konduktivitet, vilket gör att det kan reagera stabilt under elektrolys utan korrosion. Detta gör titanelektroder till ett idealiskt val för elektrolys av saltlösning.
Elektrolys av saltvatten kräver vanligtvis en extern strömkälla för att tillhandahålla energi för den elektrolytiska reaktionen. Denna strömkälla är vanligtvis en likströmskälla (DC) eftersom elektrolytiska reaktioner kräver en jämn riktning på strömflödet, och en likströmskälla kan leverera en konstant strömriktning.
Vid elektrolys av saltvatten för att generera klorgas används vanligtvis en lågspänningslikströmskälla. Strömförsörjningens spänning beror på specifika reaktionsförhållanden och utrustningens design, men ligger generellt mellan 2 och 4 volt. Dessutom är strömförsörjningens strömstyrka en avgörande parameter som måste bestämmas baserat på reaktionskammarens storlek och önskat produktionsutbyte.
Sammanfattningsvis beror valet av strömförsörjning för elektrolys av saltvatten på de specifika kraven för experiment eller industriella processer för att säkerställa effektiv reaktion och uppnåendet av de önskade produkterna.
Publiceringstid: 16 januari 2024